Tosilato de Sorafenibe
Princípio/forma ativa - Bula - Tosilato de Sorafenibe
Para que serve?
Tratamento de pacientes com carcinoma celular renal avançado que não responderam à terapia com alfainterferona ou interleucina-2 ou não eram elegíveis para tal terapia.
Tratamento de pacientes com carcinoma hepatocelular não ressecável.
Tratamento de pacientes com carcinoma de tireoide diferenciado (papilífero, folicular, célula de Hurthle) localmente avançado ou metastático, progressivo, refratário a iodo radioativo.
Contraindicação
Tosilato de Sorafenibe é contraindicado em pacientes com hipersensibilidade grave conhecida ao sorafenibe ou a qualquer um dos excipientes.
Posologia e como usar
Uso oral.
Os comprimidos devem ser deglutidos com um pouco de água.
A dose diária total recomendada é de 800 mg de sorafenibe administrados em forma de 2 comprimidos de 200 mg, duas vezes ao dia, entre as refeições ou durante refeições com pouca ou moderada quantidade de gordura.
Recomenda-se que Tosilato de Sorafenibe seja tomado entre as refeições ou durante refeições com pouca ou moderada gordura. Se o paciente for ingerir uma refeição rica em gordura, Tosilato de Sorafenibe deve ser tomado pelo menos 1 hora antes ou 2 horas após a refeição. Quando Tosilato de Sorafenibe é administrado durante uma refeição com gordura moderada, a biodisponibilidade é similar à registrada em jejum. Com uma refeição rica em gordura, a biodisponibilidade do sorafenibe é reduzida em 29% em comparação com a administração em jejum.
Se uma dose de Tosilato de Sorafenibe for esquecida, deve-se ingeri-la o quanto antes. Se for perto do horário da próxima dose, não se deve ingerir a dose esquecida. Não se deve ingerir duas doses para compensar a dose esquecida.
O tratamento deve continuar até que não haja mais nenhum benefício clínico para o paciente ou até que se manifeste alguma toxicidade inaceitável.
No caso de suspeita de reações adversas pode ser necessário interromper temporariamente e/ou reduzir a dose de Tosilato de Sorafenibe.
Quando for preciso reduzir a dose durante o tratamento de carcinoma hepatocelular (CHC) e de carcinoma celular renal (CCR) avançado, essa redução deve ser para 2 comprimidos de 200 mg uma vez ao dia.
Modificações de dose sugeridas em caso de toxicidade cutânea em pacientes com CHC e CCR:
No caso de suspeita de reações adversas pode ser necessário interromper temporariamente e/ou reduzir a dose de Tosilato de Sorafenibe.
Quando for preciso reduzir a dose durante o tratamento de carcinoma de tireoide diferenciado, a posologia de Tosilato de Sorafenibe poderá ser reduzida para 600 mg ao dia em doses divididas (dois comprimidos de 200 mg e um comprimido de 200 mg administrados com intervalo de 12 horas).
Se for necessária redução adicional, a posologia de Tosilato de Sorafenibe pode ser reduzida para um comprimido de 200 mg duas vezes ao dia, seguida de um comprimido de 200 mg uma vez ao dia.
Após a melhora das reações adversas não hematológicas, a dose de sorafenibe pode ser aumentada.
Tabela 4: Níveis de redução de dose sugeridos para pacientes com carcinoma de tireoide diferenciado:
Tabela 5: Modificações de dose sugeridas em caso de toxicidade cutânea em pacientes com carcinoma de tireoide diferenciado:
*Para pacientes que requeiram redução da dose por toxicidade cutânea de graus 2 ou 3, a dose reduzida de de Tosilato de Sorafenibe deverá ser mantida durante pelo menos 28 dias após o retorno da toxicidade cutânea para os graus 0-1.
Nenhum ajuste de dose é necessário com base na idade (acima de 65 anos), no gênero ou no peso corporal do paciente.
A segurança e a eficácia de sorafenibe não foram estabelecidas em pacientes pediátricos.
Não há necessidade de ajuste de dose em pacientes com insuficiência hepática Child-Pugh A ou B. Não se estudou sorafenibe em pacientes com insuficiência hepática Child-Pugh C.
Não há necessidade de ajuste de dose em pacientes com insuficiência renal leve, moderada ou grave que não requeira diálise. O sorafenibe não foi estudado em pacientes que estão sendo submetidos à diálise.
Recomenda-se monitorar o equilíbrio hidroeletrolítico nos pacientes com risco de disfunção renal.
Este medicamento não deve ser partido, aberto ou mastigado.
Reações Adversas
As reações adversas mais comuns foram diarreia , fadiga , alopecia , infecção, reação cutânea mão-pé (corresponde à síndrome de eritrodisestesia palmo-plantar no MedDRA) e rash .
Os dados descritos nesta seção refletem a exposição ao Tosilato de Sorafenibe de 955 pacientes com carcinoma hepatocelular (n=297), carcinoma celular renal avançado (n=451) ou carcinoma de tireoide (n=207) que participaram de estudos controlados com placebo.
Os eventos adversos mais comuns, que foram considerados relacionados ao Tosilato de Sorafenibe nos pacientes com CCR, CHC ou carcinoma de tireoide são fadiga, perda de peso, reação cutânea mão-pé, alopecia, diarreia, anorexia , náusea , dor abdominal, hipertensão, infecção e hemorragia.
As taxas de reações adversas observadas nos estudos clínicos não podem ser comparadas diretamente de um medicamento a outro e podem não refletir as taxas observadas na prática, por serem os estudos clínicos conduzidos sob uma ampla variedade de condições.
Reações adversas no carcinoma hepatocelular (CHC), estudo 100554 A tabela 6 mostra a porcentagem de pacientes com CHC que apresentaram eventos adversos, relatados em pelo menos 10% dos pacientes e a uma taxa maior no grupo de Tosilato de Sorafenibe do que no grupo placebo no estudo 100554. Eventos adversos classificados como Grau 3 CTCAE (“ Common Terminology Criteria for Adverse Events ”), foram relatados em 39% dos pacientes que receberam Tosilato de Sorafenibe, comparados a 24% dos pacientes que receberam placebo. Eventos adversos de Grau 4 (CTCAE) foram relatados em 6% dos pacientes que receberam Tosilato de Sorafenibe, comparados a 8% dos pacientes que receberam placebo.
Tabela 6 - Eventos adversos relatados em pelo menos 10% dos pacientes e a uma taxa superior no grupo de Tosilato de Sorafenibe em relação ao grupo placebo – Estudo 100554 (CHC):

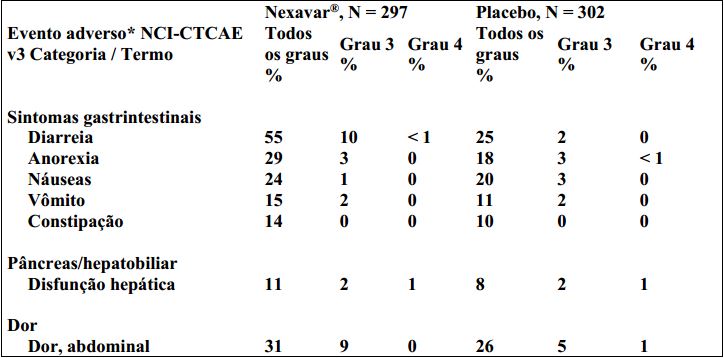 * No estudo 100554 (CHC), a taxa de ascite foi similar em ambos os grupos, Tosilato de Sorafenibe e placebo.
* No estudo 100554 (CHC), a taxa de ascite foi similar em ambos os grupos, Tosilato de Sorafenibe e placebo.
Foi relatada hipertensão em 9% dos pacientes que receberam Tosilato de Sorafenibe e 4% daqueles que receberam placebo. Hipertensão de Grau 3 CTCAE foi relatada em 4% dos pacientes que receberam Tosilato de Sorafenibe e 1% dos pacientes que receberam placebo. Não foram relatados eventos grau 4 CTCAE em nenhum paciente de ambos os grupos.
Hemorragias/sangramentos foram relatados em 20% dos pacientes que receberam placebo e 18% daqueles que receberam Tosilato de Sorafenibe. As taxas de sangramento Graus 3 e 4 CTCAE foram também mais altas no grupo placebo (Grau 3 CTCAE em 5% no grupo placebo e 3% no grupo que recebeu Tosilato de Sorafenibe e Grau 4 CTCAE em 4% no grupo placebo e 2% no grupo que recebeu Tosilato de Sorafenibe). Foram relatados sangramentos de varizes esofágicas em 4% dos pacientes que receberam placebo e 2,4% dos que receberam Tosilato de Sorafenibe.
Foi relatada insuficiência renal em 2,6% dos pacientes que receberam placebo e em 0,3% daqueles que receberam Tosilato de Sorafenibe.
A Tabela 7 mostra a porcentagem de pacientes com CCR que apresentaram eventos adversos relatados em pelo menos 10% dos pacientes e a uma taxa mais alta no grupo que recebeu Tosilato de Sorafenibe do que no grupo que recebeu placebo no estudo 11213. Eventos adversos de Grau 3 CTCAE foram relatados em 31% dos pacientes que receberam Tosilato de Sorafenibe comparados com 22% dos pacientes que receberam placebo. Eventos adversos de Grau 4 CTCAE foram relatados em 7% dos pacientes que receberam Tosilato de Sorafenibe comparados aos 6% dos pacientes que receberam placebo.
Tabela 7: Eventos adversos decorrentes do tratamento relatados em pelo menos 10% de pacientes que receberam Tosilato de Sorafenibe – estudo 11213 (CCR):

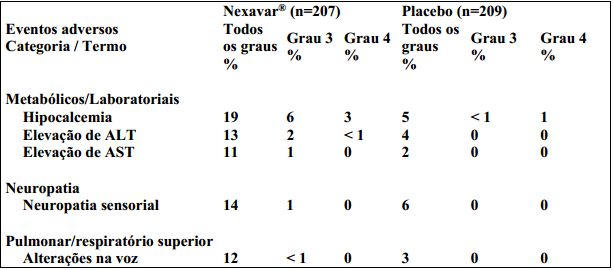
Reações adversas no estudo de carcinoma de tireoide diferenciado: período duplocego A Tabela 8 mostra a porcentagem de pacientes com carcinoma de tireoide diferenciado que apresentaram eventos adversos relatados em pelo menos 10% dos pacientes e a uma taxa mais alta nos indivíduos que receberam Tosilato de Sorafenibe do que no grupo placebo na fase duplo-cega. Eventos adversos Grau 3 CTCAE foram relatados em 53% dos pacientes que receberam Tosilato de Sorafenibe em comparação com 23% dos pacientes que receberam placebo. Eventos adversos Grau 4 CTCAE foram relatados em 12% dos pacientes que receberam Tosilato de Sorafenibe em comparação com 7% dos pacientes recebendo placebo.
Tabela 8. Reações adversas ao medicamento (>10%) relatadas em pacientes que receberam Tosilato de Sorafenibe e mais comuns do que em pacientes que receberam placebo. (estudo de carcinoma de tireoide diferenciado, período duplo-cego, população da análise de segurança, CTCAE versão 3.0):

Relataram-se os seguintes eventos adversos relacionados ao fármaco, além de alterações laboratoriais, nos estudos clínicos realizados com sorafenibe (10% ou mais = muito comum; 1 a <10% = comum; 0,1 a < 1% = incomum; 0,01 a <0,1% = rara):
*Essas reações adversas podem ser potencialmente fatais ou fatais. Tais eventos são incomuns ou de incidência mais baixa que incomum.
Adicionalmente, os seguintes eventos adversos clinicamente significativos foram relatados de modo infrequente durante os estudos clínicos de Tosilato de Sorafenibe: ataque isquêmico transitório, arritmia e tromboembolismo. Para esses eventos não se estabeleceu uma relação causal com Tosilato de Sorafenibe.
Dois estudos controlados por placebo, randomizados, comparando eficácia e segurança do sorafenibe em combinação com quimioterapias baseadas em combinação de platina com outro agente ( carboplatina /paclitaxel e separadamente gencitabina/cisplatina) versus a respectiva quimioterapia baseada em combinações com platina apenas como primeira linha de tratamento para pacientes com carcinoma avançado de pulmão de células não pequenas (NSCLC) não atingiram o objetivo primário de melhora da sobrevida global.
Eventos de segurança foram geralmente consistentes com aqueles previamente relatados. Entretanto, em ambos os estudos, foi observada mortalidade mais alta no subgrupo de pacientes com carcinoma espinocelular de pulmão que receberam sorafenibe e quimioterapias baseadas em combinações com platina versus aqueles que receberam quimioterapia baseada em combinações com platina apenas ( paclitaxel /carboplatina: HR 1,81; IC 95% 1,19-2,74; gencitabina/cisplatina: HR 1,22; IC 95% 0,82 – 1,80). Não foi encontrada uma causa definitiva para os achados.
A segurança também foi avaliada em um conjunto constituído por 638 pacientes que receberam Tosilato de Sorafenibe em estudos Fase II, incluindo 202 pacientes com carcinoma de células renais, 137 pacientes com carcinoma hepatocelular e 299 pacientes com outros cânceres. Os eventos adversos mais comuns relacionados ao fármaco e relatados em pacientes que receberam Tosilato de Sorafenibe nesses estudos foram rash (38%), diarreia (37%), reação palmo-plantar (35%) e fadiga (33%). As respectivas taxas de eventos adversos Grau 3 e 4 CTC (“ Common Toxicity Criteria of National Cancer Institute – v 2.0”) relacionados ao fármaco, em pacientes que receberam Tosilato de Sorafenibe, foram 37% e 3%, respectivamente.
As seguintes reações adversas ao medicamento foram identificadas durante o uso de Tosilato de Sorafenibe após sua aprovação. Uma vez que estas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com certeza a frequência dessas reações ou estabelecer relação causal com a exposição ao medicamento.
Dermatite de “ recall ” induzida por radiação (“ radiation recall dermatitis "), síndrome de Stevens-Johnson, vasculite leucocitoclástica, necrólise epidérmica tóxica*.
Angioedema .
Rabdomiólise .
Eventos do tipo doença pulmonar intersticial (que podem ser potencialmente fatais ou fatais).
*Essas reações adversas podem ser potencialmente fatais ou fatais. Tais eventos são incomuns ou de incidência mais baixa que incomum.
Elevações nos níveis de lipase e amilase foram relatadas com muita frequência. No estudo 11213 ocorreram elevações de lipase de graus 3 ou 4 CTCAE em 12% dos pacientes no grupo que recebeu sorafenibe, em comparação com 7% dos pacientes no grupo placebo. Foram relatadas elevações da amilase de graus 3 ou 4 CTCAE em 1% dos pacientes no grupo que recebeu sorafenibe, em comparação com 3% dos pacientes no grupo placebo. No estudo 1 observou-se pancreatite clínica (grau 4 CTCAE) em 2 dos 451 pacientes que receberam sorafenibe e em 1 dos 451 pacientes (grau 2 CTCAE) no grupo de placebo.
A hipofosfatemia foi um achado laboratorial comum, observada em 45% dos pacientes que receberam sorafenibe comparado com 11% dos pacientes que receberam placebo. Hipofosfatemia grau 3 CTCAE (1-2 mg/dL) ocorreu em 13% dos pacientes que receberam sorafenibe e 3% dos pacientes do grupo placebo. Não foram relatados casos de hipofosfatemia grau 4 CTCAE (<1 mg/dL) em pacientes que receberam sorafenibe ou do grupo placebo. A etiologia da hipofosfatemia associada ao sorafenibe não é conhecida.
Foi relatada linfopenia graus 3 ou 4 CTCAE em 13% dos pacientes que receberam sorafenibe e 7% dos pacientes que receberam placebo, neutropenia em 5% dos pacientes que receberam sorafenibe e 2% dos pacientes que receberam placebo, anemia em 2% dos pacientes que receberam sorafenibe e 4% dos pacientes que receberam placebo e trombocitopenia em 1% dos pacientes que receberam sorafenibe e 0% dos pacientes que receberam placebo.
Foi relatada hipocalcemia em 12% dos pacientes que receberam sorafenibe comparado com 7,5% nos pacientes do grupo placebo. A maioria dos relatos foi de baixo grau (graus 1 e 2 CTCAE). Hipocalcemia grau 3 CTCAE (6,0 – 7,0 mg/dL) ocorreu em 1,1% dos pacientes que receberam sorafenibe e em 0,2% dos pacientes do grupo placebo. Hipocalcemia grau 4 CTCAE (< 6,0 mg/dL) ocorreu em 1,1% dos pacientes que receberam sorafenibe e em 0,5% dos pacientes do grupo placebo. A etiologia da hipocalcemia associada ao sorafenibe não é conhecida.
Foi relatada hipocalemia em 5,4% dos pacientes que receberam sorafenibe comparado com 0,7% dos pacientes que receberam placebo. A maioria dos relatos de hipocalemia foram de baixo grau (grau 1 CTCAE). Hipocalemia de grau 3 CTCAE ocorreu em 1,3% dos pacientes que receberam sorafenibe e 0,2% dos pacientes no grupo placebo. Não houve relatos de hipocalemia grau 4.
Observaram-se elevações nos níveis de lipase em 40% dos pacientes que receberam Tosilato de Sorafenibe comparados com 37% dos pacientes no grupo placebo. Essas elevações foram de graus 3 ou 4 CTCAE em 9% dos pacientes em cada grupo. Observaramse elevações da amilase em 34% dos pacientes que receberam Tosilato de Sorafenibe comparados com 29% dos pacientes no grupo placebo. Foram relatadas elevações da amilase de graus 3 ou 4 CTCAE em 2% dos pacientes de cada grupo. Muitas das elevações de lipase e amilase foram transitórias e na maioria dos casos não foi interrompido o tratamento com Tosilato de Sorafenibe. Relatou-se pancreatite clínica em 1 dos 297 pacientes que receberam Tosilato de Sorafenibe (grau 2 CTCAE).
A hipofosfatemia foi um achado laboratorial comum, observada em 35% dos pacientes que receberam Tosilato de Sorafenibe comparado com 11% dos pacientes que receberam placebo. Hipofosfatemia grau 3 CTCAE (1-2 mg/dL) ocorreu em 11% dos pacientes que receberam Tosilato de Sorafenibe e 2% dos pacientes do grupo placebo.
Houve um caso de hipofosfatemia grau 4 CTCAE (<1 mg/dL) relatado no grupo placebo. A etiologia da hipofosfatemia associada ao Tosilato de Sorafenibe não é conhecida.
Elevações nos testes de função hepática foram comparáveis entre os 2 braços do estudo. Foram observados níveis elevados de aspartato aminotransferase (AST) em 94% dos pacientes que receberam Tosilato de Sorafenibe e 91% dos pacientes que receberam placebo. Elevações de AST graus 3 ou 4 CTCAE foram relatadas em 16% dos pacientes que receberam Tosilato de Sorafenibe e 17% dos pacientes no grupo placebo.
Elevações de alanina aminotrasferase (ALT) foram observadas em 69% dos pacientes que receberam Tosilato de Sorafenibe e 68% dos pacientes que receberam placebo.
Elevações de ALT graus 3 ou 4 CTCAE foram relatadas em 3% dos pacientes que receberam Tosilato de Sorafenibe e 8% dos pacientes que receberam placebo. Foram observados níveis elevados de bilirrubina em 47% dos pacientes que receberam Tosilato de Sorafenibe e 45% dos pacientes que receberam placebo. Elevações de bilirrubina graus 3 ou 4 CTCAE foram relatadas em 10% dos pacientes que receberam Tosilato de Sorafenibe e 11% dos pacientes que receberam placebo. Hipoalbuminemia foi observada em 59% dos pacientes que receberam Tosilato de Sorafenibe e 47% dos pacientes que receberam placebo. Hipoalbuminemia de graus 3 ou 4 CTCAE não foi observada em nenhum dos grupos.
Elevações de fosfatase alcalina foram observadas em 82,2% dos pacientes que receberam Tosilato de Sorafenibe e 82,5% dos pacientes que receberam placebo. Elevações de fosfatase alcalina grau 3 CTCAE foram relatadas em 6,2% dos pacientes que receberam Tosilato de Sorafenibe e 8,2% dos pacientes que receberam placebo. Elevação de fosfatase alcalina grau 4 CTCAE não foi observada em nenhum dos grupos.
Elevações de RNI foram observadas em 42% dos pacientes que receberam Tosilato de Sorafenibe e 34% dos pacientes que receberam placebo. Elevações de RNI grau 3 CTCAE foram relatadas em 4% dos pacientes que receberam Tosilato de Sorafenibe e 2% dos pacientes que receberam placebo. Não houve elevação de RNI grau 4 CTCAE em nenhum dos grupos.
Linfopenia foi observada em 47% dos pacientes que receberam Tosilato de Sorafenibe e 42% dos pacientes que receberam placebo. Linfopenia de graus 3 ou 4 CTCAE foi relatada em 6% dos pacientes em cada grupo. Neutropenia foi observada em 11% dos pacientes que receberam Tosilato de Sorafenibe e 14% dos pacientes que receberam placebo. Neutropenia de graus 3 ou 4 CTCAE foi relatada em 1% de pacientes em cada grupo.
Anemia foi observada em 59% dos pacientes que receberam Tosilato de Sorafenibe e 64% dos pacientes que receberam placebo. Anemia de graus 3 ou 4 CTCAE foi relatada em 3% dos pacientes em cada grupo.
Trombocitopenia foi observada em 46% dos pacientes que receberam Tosilato de Sorafenibe e 41% dos pacientes que receberam placebo. Trombocitopenia de graus 3 ou 4 CTCAE foi relatada em 4% dos pacientes que receberam Tosilato de Sorafenibe e em menos de 1% dos pacientes que receberam placebo.
Foi relatada hipocalcemia em 26,5% dos pacientes que receberam sorafenibe comparado com 14,8% nos pacientes do grupo placebo. A maioria dos relatos foi de baixo grau (graus 1 e 2 CTCAE). Hipocalcemia grau 3 CTCAE (6,0 – 7,0 mg/dL) ocorreu em 1,8% dos pacientes que receberam sorafenibe e em 1,1% dos pacientes do grupo placebo. Hipocalcemia grau 4 CTCAE (< 6,0 mg/dL) ocorreu em 0,4% dos pacientes que receberam sorafenibe e em 0% dos pacientes do grupo placebo. A etiologia da hipocalcemia associada ao sorafenibe não é conhecida.
Foi relatada hipocalemia em 9,4% dos pacientes que receberam sorafenibe comparado com 5,9% dos pacientes do grupo placebo. A maioria dos relatos de hipocalemia foram de grau baixo (grau 1 CTCAE). Hipocalemia de grau 3 CTCAE ocorreu em 0,3% dos pacientes que receberam sorafenibe e 0,7% dos pacientes do grupo placebo. Não houve relatos de hipocalemia grau 4.
Foi relatada hipocalcemia em 35,7% dos pacientes que receberam sorafenibe em comparação com 11,0% dos pacientes do grupo placebo. A maioria dos relatos de hipocalcemia foi de grau baixo. Hipocalcemia grau 3 CTCAE ocorreu em 6,8% dos pacientes que receberam sorafenibe e em 1,9% dos pacientes do grupo placebo, e hipocalcemia grau 4 CTCAE ocorreu em 3,4% dos pacientes que receberam sorafenibe e em 1,0% dos pacientes do grupo placebo.
Tabela 9: Alterações em exames laboratoriais decorrentes do tratamento, relatadas em pacientes com carcinoma de tireoide diferenciado, no período duplo-cego:
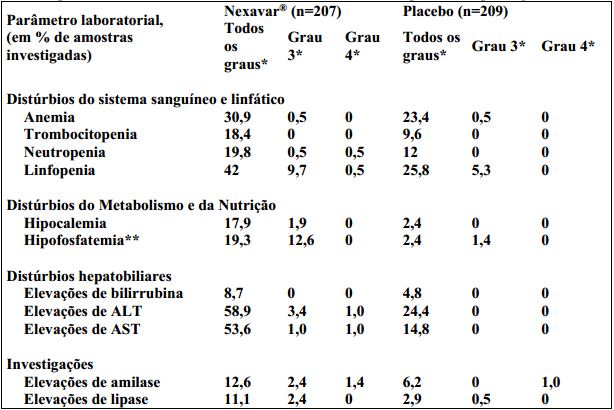 * Common Terminology Criteria for Adverse Events (CTCAE), versão 3.0.
* Common Terminology Criteria for Adverse Events (CTCAE), versão 3.0.
** A etiologia da hipofosfatemia associada a Tosilato de Sorafenibe é desconhecida.
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Interação medicamentosa
A administração concomitante contínua de sorafenibe e rifampicina reduziu a AUC de sorafenibe em 37%, em média. Outros indutores da atividade do CYP3A4 (por exemplo, Hypericum perforatum , conhecido como Erva de São João, fenitoína , carbamazepina , fenobarbital e dexametasona ) também podem aumentar o metabolismo do sorafenibe e consequentemente reduzir suas concentrações.
O cetoconazol , um potente inibidor do CYP3A4, administrado uma vez ao dia durante 7 dias a voluntários sadios do sexo masculino, não alterou a AUC média de uma dose única de 50 mg de sorafenibe.
Portanto, as interações farmacocinéticas clínicas de sorafenibe com os inibidores de CYP3A4 são improváveis.
Avaliou-se o possível efeito de sorafenibe sobre a varfarina (um substrato do CYP2C9) em pacientes que receberam sorafenibe em comparação com pacientes que receberam placebo. O tratamento concomitante com sorafenibe e varfarina não resultou em alterações no TP (tempo de protrombina) RNI médio em comparação com placebo. Entretanto, é necessário monitorar regularmente a RNI de pacientes que tomam varfarina.
A administração concomitante de midazolam , dextrometorfano e omeprazol , substratos dos citocromos CYP3A4, CYP2D6 e CYP2C19 respectivamente, após 4 semanas de administração de sorafenibe, não alterou a exposição a esses agentes, indicando que o sorafenibe não inibe nem induz as isoenzimas do citocromo P450. Em um estudo clínico separado, a administração concomitante de sorafenibe e paclitaxel resultou em um aumento, ao invés de diminuição, da exposição ao 6-OH paclitaxel, metabólito ativo do paclitaxel formado pelo CYP2C8. Esses dados sugerem que o sorafenibe pode não ser um inibidor in vivo do CYP2C8. Em outro estudo clínico, a administração concomitante de sorafenibe e ciclofosfamida resultou em uma pequena diminuição na exposição à ciclofosfamida, mas não diminuiu a exposição sistêmica à 4-OH ciclofosfamida, metabólito ativo da ciclofosfamida formado principalmente pelo CYP2B6. Esses dados sugerem que o sorafenibe pode não ser um inibidor in vivo do CYP2B6.
O sorafenibe demonstrou inibir a proteína transportadora glicoproteína-P (gp-P) in vitro . O aumento das concentrações plasmáticas dos substratos de gp-P, como a digoxina , não pode ser excluído com o tratamento concomitante com sorafenibe.
Em estudos clínicos, administrou-se sorafenibe em combinação com uma série de outros agentes antineoplásicos nas suas posologias habituais, incluindo gencitabina , cisplatina , oxaliplatina , paclitaxel , carboplatina , capecitabina , doxorrubicina , docetaxel , irinotecano e ciclofosfamida . O sorafenibe não teve efeito clinicamente relevante na farmacocinética da gencitabina, cisplatina, carboplatina, oxaliplatina ou ciclofosfamida.
A administração de paclitaxel (225 mg/m 2 ) e carboplatina (AUC = 6) com sorafenibe (≤ 400 mg duas vezes ao dia), administrados com uma pausa de 3 dias na administração de sorafenibe para administração de paclitaxel / carboplatina, não resultou em efeito significativo na farmacocinética do paclitaxel.
A coadministração de paclitaxel (225 mg/m 2 , uma vez a cada 3 semanas) e carboplatina (AUC = 6) com sorafenibe (400 mg duas vezes ao dia, sem pausa na administração de sorafenibe) resultou em um aumento de 47% da exposição ao sorafenibe, 29% da exposição ao paclitaxel e 50% da exposição ao 6-OH paclitaxel.
A farmacocinética da carboplatina não foi afetada.
Esses dados indicam que não é necessário ajuste de dose quando paclitaxel e carboplatina são coadministrados com sorafenibe com pausa de 3 dias na administração de sorafenibe. A relevância clínica do aumento da exposição ao sorafenibe e paclitaxel, após a coadministração sem pausa de sorafenibe é desconhecida.
A coadministração de capecitabina (750 – 1.050 mg/m 2 , duas vezes ao dia, dias 1 – 14 a cada 21 dias) e sorafenibe (200 ou 400 mg duas vezes ao dia, administração contínua ininterrupta) não resultou em alteração significativa na exposição ao sorafenibe, mas em um aumento de 15 – 50% na exposição da capecitabina e um aumento de 0 – 52% na exposição ao 5-FU. A relevância clínica deste aumento leve a moderado na exposição da capecitabina e 5-FU quando coadministrados com sorafenibe é desconhecida.
O tratamento concomitante com sorafenibe resultou em aumento de 21% na AUC da doxorrubicina. Quando se administrou com irinotecano, cujo metabólito ativo SN-38 é adicionalmente metabolizado pela via UGT1A1, produziu-se aumento de 67 – 120% da AUC do SN-38 e aumento de 26 – 42% da AUC do irinotecano. Não se conhece a relevância clínica desses resultados.
A coadministração de sorafenibe (200 mg duas vezes/dia ou 400 mg duas vezes/dia, administrados do 2° ao 19° dias de cada ciclo de 21 dias) e de docetaxel (75 ou 100 mg/m², administrado uma vez a cada 21 dias) com uma pausa de 3 dias em torno da administração de docetaxel resultou em um aumento de 36 – 80% na AUC de docetaxel e de 16–32% na C máx de docetaxel. Recomenda-se cautela ao administrar sorafenibe com docetaxel.
A coadministração de neomicina, um agente antimicrobiano não sistêmico, utilizado na erradicação da flora gastrintestinal, interfere na reciclagem entêro-hepática do sorafenibe resultando na diminuição da exposição a esse medicamento. Em voluntários sadios, tratados com neomicina por 5 dias, a biodisponibilidade média do sorafenibe diminuiu em 54%. A relevância clínica desses achados é desconhecida. Não foram estudados os efeitos de outros antibióticos, mas provavelmente dependerão da capacidade do antibiótico em diminuir a atividade da glicuronidase.
A coadministração de omeprazol não tem impacto na farmacocinética do sorafenibe. Não é necessário ajustar a dose do sorafenibe.
Precauções
Reações dermatológicas As reações adversas mais comuns com sorafenibe são reação palmo-plantar (eritrodisestesia palmo-plantar) e o rash cutâneo. Essas reações são geralmente de grau 1 e 2 de acordo com a CTC (“ Common Toxicity Criteria ”) do NCI (“ National Cancer Institute ”) e, em geral, surgem durante as primeiras 6 semanas de tratamento com sorafenibe. O controle das reações dermatológicas pode incluir tratamento tópico para alívio sintomático, interrupção temporária do tratamento e/ou modificação da dose de sorafenibe ou, em casos graves ou persistentes, interrupção permanente do tratamento.
Observou-se aumento da incidência de hipertensão em pacientes que receberam sorafenibe. Em geral, a hipertensão foi leve a moderada, surgiu no início do tratamento e foi controlável com tratamento anti-hipertensivo padrão. A pressão arterial deve ser monitorada regularmente e tratada, se necessário, de acordo com as condutas médicas padrão. Em caso de hipertensão grave, persistente ou de crises hipertensivas apesar do tratamento anti-hipertensivo adequado, deve-se considerar a descontinuação permanente do sorafenibe.
Pode ocorrer aumento do risco de hemorragias após administração de sorafenibe. A incidência de eventos hemorrágicos graves é incomum. Se um evento hemorrágico precisar de intervenção médica, recomenda-se considerar a descontinuação permanente de sorafenibe. Devido ao risco potencial de sangramento, infiltração da traqueia, dos brônquios, e do esôfago deve ser tratada com terapia localizada antes da administração de Tosilato de Sorafenibe em pacientes com carcinoma de tireoide diferenciado.
Há relatos incomuns de eventos hemorrágicos ou de elevações da relação normalizada internacional – RNI (“INR – International Normalized Ratio ”) em alguns pacientes em uso de varfarina durante o tratamento com sorafenibe. Deve-se monitorar regularmente as alterações do tempo de protrombina, a RNI e os eventos hemorrágicos clínicos em pacientes que tomam
varfarina concomitantemente com sorafenibe.
Não foram realizados estudos formais sobre o efeito de sorafenibe na cicatrização de feridas. Em pacientes submetidos a intervenções cirúrgicas de grande porte, recomenda-se interrupção temporária do tratamento com sorafenibe como medida de precaução. A experiência clínica em relação ao intervalo de tempo para reiniciar o tratamento após intervenção cirúrgica de grande porte é limitada. Portanto, a decisão de reiniciar o tratamento com sorafenibe nessa situação deve basear-se no julgamento clínico da cicatrização adequada da ferida.
A incidência de isquemia cardíaca ou infarto de miocárdio, surgidos durante o tratamento no estudo 11213, foi maior no grupo que recebeu sorafenibe (4,9%) comparado com o grupo placebo (0,4%). A incidência de isquemia cardíaca ou infarto de miocárdio, surgidos durante o tratamento no estudo 100554 foi de 2,7% no grupo que recebeu sorafenibe comparado com 1,3% no grupo placebo. Pacientes com doença arterial coronariana instável ou infarto do miocárdio recente foram excluídos destes estudos. Deve-se considerar a descontinuação temporária ou permanente de sorafenibe em pacientes que desenvolverem isquemia cardíaca e/ou infarto.
Tosilato de Sorafenibe tem mostrado prolongar o intervalo QT/QTc que pode levar a um risco aumentado de arritmias ventriculares. O sorafenibe deve ser utilizado com cautela em pacientes que têm ou podem desenvolver prolongamento do QTc, assim como pacientes com síndrome congênita do QT longo, pacientes tratados com altas doses cumulativas de antraciclina, pacientes tomando certos medicamentos antiarrítmicos ou outros medicamentos que levam ao prolongamento do QT e aqueles pacientes com distúrbios eletrolíticos como hipocalemia, hipocalcemia ou hipomagnesemia. O monitoramento periódico durante o tratamento com eletrocardiogramas e avaliação dos eletrólitos ( magnésio , potássio , cálcio ) deve ser considerado quando Tosilato de Sorafenibe for utilizado nestes pacientes.
Perfuração gastrintestinal é incomum e foi notificada em menos de 1% dos pacientes em uso de sorafenibe. Em alguns casos não estava relacionada a um tumor intra-abdominal evidente. O tratamento com sorafenibe deverá ser descontinuado.
Não há dados disponíveis para pacientes com insuficiência hepática grave (Child-Pugh C). O sorafenibe é eliminado principalmente por via hepática, o que poderá aumentar a exposição nesses pacientes.
Ao utilizar Tosilato de Sorafenibe em pacientes com carcinoma de tireoide diferenciado, é recomendado acompanhamento cuidadoso dos níveis de cálcio no sangue. Nos estudos clínicos, hipocalcemia foi mais frequente e mais grave em pacientes com carcinoma de tireoide diferenciado, especialmente naqueles com histórico de hipoparatireoidismo, em comparação com os pacientes com carcinoma celular renal ou carcinoma hepatocelular.
Hipocalcemia severa deve ser corrigida para prevenir complicações, como prolongamento do intervalo QT ou “ torsades de pointes ”.
Nos estudos clínicos de CTD, foram observados aumentos nos níveis de TSH acima de 0,5 mU/L entre os pacientes que utilizavam Tosilato de Sorafenibe. Ao se utilizar Tosilato de Sorafenibe em pacientes com carcinoma de tireoide diferenciado, é recomendado acompanhamento cuidadoso dos níveis de TSH.
Antes de iniciar o tratamento, os médicos são aconselhados a avaliar cuidadosamente o prognóstico individual do paciente considerando o tamanho máximo da lesão, os sintomas relacionados com a doença e a taxa de progressão. O manejo das possíveis reações adversas ao medicamento pode exigir interrupção temporária ou redução de dose da terapia com sorafenibe. No estudo 4, 37% dos indivíduos tiveram interrupção da dose e 35% tiveram redução da dose já no 1º ciclo do tratamento com sorafenibe. As reduções de doses tiveram apenas sucesso parcial em amenizar as reações adversas. Portanto, avaliações repetidas de risco-benefício são recomendadas levando em conta a atividade antitumoral e tolerabilidade.
Recomenda-se cautela na administração de sorafenibe junto com compostos metabolizados/eliminados predominantemente pela via UGT1A1 (por exemplo, irinotecano).
O uso concomitante de docetaxel (75 ou 100 mg/m 2 ) e sorafenibe (200 ou 400 mg, duas vezes ao dia), administrado com uma pausa de 3 dias em torno da administração de docetaxel, resultou em um aumento de 36 – 80% da AUC de docetaxel. Recomenda-se cautela ao administrar sorafenibe com docetaxe.
A coadministração de neomicina pode causar uma diminuição na biodisponibilidade do sorafenibe.
Não existem estudos adequados e bem controlados realizados com mulheres grávidas que estivessem utilizando sorafenibe. Os estudos em animais demonstraram toxicidade reprodutiva, incluindo malformações. Demonstrou-se que sorafenibe e seus metabólitos atravessam a barreira placentária em ratas e presume-se que sorafenibe iniba a angiogênese no feto.
A gravidez deve ser evitada durante o tratamento com Tosilato de Sorafenibe. Mulheres em idade fértil devem tomar conhecimento do risco potencial para o feto, que inclui malformação grave (teratogenicidade), desenvolvimento insuficiente e morte fetal (embriotoxicidade).
O sorafenibe não deve ser usado durante a gravidez. O médico somente deve considerar seu uso quando os benefícios potenciais justificarem os riscos potenciais para o feto.
Categoria D.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
O sorafenibe demonstrou ser teratogênico e embriotóxico em animais. Durante o tratamento e pelo menos nas 2 semanas após o término do tratamento, deve-se adotar um método contraceptivo adequado.
Não se sabe se sorafenibe é excretado no leite humano. Em animais, sorafenibe e/ou seus metabólitos foram excretados no leite. Considerando-se que muitos fármacos são excretados no leite humano e que os efeitos de sorafenibe não foram estudados em crianças, a mulher deve interromper a amamentação durante o tratamento com sorafenibe.
Os resultados de estudos em animais indicam que sorafenibe pode prejudicar a fertilidade masculina e feminina.
Não foram conduzidos estudos sobre o efeito de sorafenibe na capacidade de dirigir veículos ou de operar máquinas. Não há evidência de que sorafenibe afete a habilidade de dirigir ou de operar máquinas.
Resultados de eficácia
A segurança e eficácia de Tosilato de Sorafenibe foram estudadas em pacientes com carcinoma hepatocelular (CHC), em pacientes com carcinoma de células renais (CCR) avançado e em pacientes com carcinoma de tireoide diferenciado (CTD).
Foi um estudo Fase III internacional, multicêntrico, randomizado, duplo-cego e controlado com placebo, conduzido em 602 pacientes com carcinoma hepatocelular. O objetivo primário do estudo foi a sobrevida global e o objetivo secundário foi o tempo até a progressão (TTP).
As características demográficas e da doença no período basal foram comparáveis entre os grupos de Tosilato de Sorafenibe e placebo com relação a idade, gênero, raça, “ performance status ”, etiologia (incluindo hepatite B , hepatite C e doença hepática alcoólica), estadio TNM (estadio I: < 1% vs. < 1%; estadio II: 10,4% vs . 8,3%; estadio III: 37,8% vs . 43,6%; estadio IV: 50,8% vs . 46,9%), ausência de invasão vascular macroscópica e de disseminação extra-hepática do tumor (30,1% vs . 30,0%), e estadio BCLC (estadio B: 18,1% vs . 16,8%; estadio C: 81,6% vs . 83,2%; estadio D: < 1% vs . 0%). A função hepática de acordo com o índice de Child-Pugh foi comparável entre os grupos de Tosilato de Sorafenibe e placebo (A: 95% vs . 98%; B: 5% vs . 2%). Somente um paciente com disfunção hepática Child-Pugh C recebeu a medicação do estudo. Tratamentos prévios incluíram procedimentos de ressecção cirúrgica (19,1% vs . 20,5%), terapias locorregionais (incluindo ablação por radiofrequência, injeção percutânea de etanol e quimioembolização transarterial; 38,8% vs . 40,6%), radioterapia (4,3% vs . 5,0%) e terapia sistêmica (3,0% vs . 5,0%).
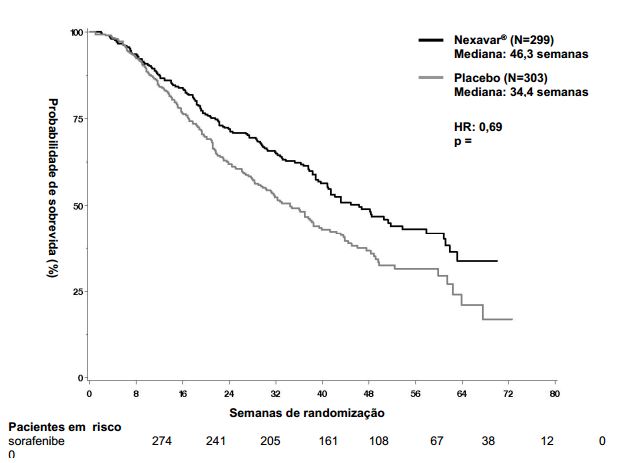
O estudo foi interrompido após uma análise interina planejada de sobrevida global haver ultrapassado o limite de eficácia pré-especificada. Esta análise mostrou uma vantagem estatisticamente significativa de Tosilato de Sorafenibe sobre o placebo para sobrevida global (HR: 0,69, p= 0,00058, veja tabela 1 e figura 1). Esta vantagem foi consistente em quase todos os subgrupos analisados. Nos fatores de estratificação pré-especificados (“ performance status ” por ECOG, presença ou ausência de invasão vascular macroscópica e/ou disseminação extra-hepática do tumor e região) o “ hazard ratio ” (HR) consistentemente favoreceu Tosilato de Sorafenibe sobre o placebo. O tempo até a progressão do tumor (TTP, por revisão radiológica independente) foi significativamente maior no grupo Tosilato de Sorafenibe (HR: 0,58, p=0,000007, veja tabela 1).
Tabela 1: Resultados de Eficácia do estudo 3 (estudo 100554) no carcinoma hepatocelular:
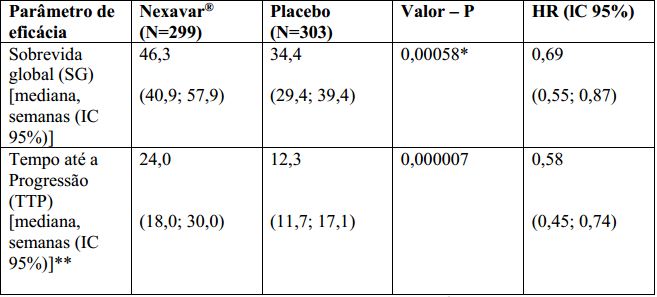
lC = intervalo de confiança, HR = “ Hazard Ratio ” (Tosilato de Sorafenibe sobre placebo).
*Estatisticamente significativa porque o valor de p foi inferior a 0,0077, limite de O’Brien Fleming pré-especificado.
** Revisão radiológica independente.
Figura 1: Curva de Kaplan-Meier de sobrevida global no estudo 3 (estudo 100554, população de “intenção de tratar”):
A segurança e eficácia de Tosilato de Sorafenibe no tratamento de carcinoma de células renais avançado (CCR) foram estudadas nos dois estudos clínicos controlados randomizados a seguir.
Foi um estudo Fase III em 903 pacientes, internacional, multicêntrico, randomizado, duplo-cego e controlado com placebo. Os objetivos primários do estudo incluíram a sobrevida global e a sobrevida livre de progressão (SLP). A taxa de resposta tumoral foi um objetivo secundário.
Os pacientes foram randomizados para receber Tosilato de Sorafenibe 400 mg duas vezes ao dia (N = 451) ou placebo (N = 452). Ao início do estudo, as características demográficas e dos pacientes foram comparáveis em ambos os grupos de tratamento. Aproximadamente metade dos pacientes apresentou “ performance status ” por ECOG (“ Eastern Cooperative Oncology Group ”) de 0, e metade dos pacientes estava no grupo prognóstico de baixo risco do MSKCC (“ Memorial Sloan Kettering Cancer Center ”).
Numa análise interina de sobrevida, planejada ao início do estudo e baseada em 220 óbitos, houve uma melhora estimada de 39% da sobrevida global de pacientes que receberam sorafenibe em comparação com o placebo. A estimativa de HR (“ hazard ratio ” - risco de morte com sorafenibe comparado com placebo) foi de 0,72 (IC 95%, 0,55 - 0,95; p = 0,018). O limiar de significância estatística para a análise intermediária foi p < 0,0005). A probabilidade de sobrevida em 1 ano foi estimada em 64,9% para o sorafenibe e 57,7% para o placebo, resultando em um NNT (número necessário para tratar) de 13,9.
A análise da SLP incluiu 769 pacientes randomizados para receber Tosilato de Sorafenibe 400 mg duas vezes ao dia (N = 384) ou placebo (N = 385). A SLP foi avaliada por revisão radiológica independente mascarada usando critérios RECIST (“ Response Evaluation Criteria in Solid Tumors ”). A mediana de SLP foi o dobro para pacientes que receberam sorafenibe (167 dias) em comparação com os pacientes que receberam placebo (84 dias) (HR = 0,44; IC 95%: 0,35 - 0,55; p < 0,000001).
O efeito na SLP também foi explorado em vários subgrupos diferentes de pacientes. Os subgrupos incluíram idade acima ou abaixo de 65 anos, “ performance status ” por ECOG de 0 ou 1, categoria 1 do índice prognóstico do MSKCC, terapia prévia para doença metastática progressiva ou para doença em estadio mais precoce e tempo a partir do diagnóstico menor ou maior que 1,5 ano. O efeito de sorafenibe sobre a SLP foi consistente nestes subgrupos, inclusive para os pacientes que não receberam terapia anterior com IL-2 ou interferona (N = 137; 65 pacientes recebendo sorafenibe, 72 recebendo placebo), para os quais a SLP mediana foi de 172 dias para o sorafenibe, em comparação com 85 dias para o placebo (HR= 0,35; IC 95%: 0,19 - 0,63).
A melhor resposta tumoral global foi determinada por revisão radiológica feita pelo pesquisador de acordo com critérios RECIST. No grupo de sorafenibe, 1 paciente (0,2%) apresentou resposta completa, 43 pacientes (9,5%) apresentaram resposta parcial e 333 pacientes (73,8%) apresentaram doença estável. No grupo placebo, nenhum paciente (0%) apresentou resposta completa, 8 pacientes (1,8%) apresentaram resposta parcial e 239 pacientes (52,9%) apresentaram doença estável.
O tratamento com sorafenibe não resultou em deterioração geral dos sintomas específicos de câncer renal (FKSI-10) ou na qualidade de vida relacionada à saúde, em comparação com o placebo. Após 18 e 24 semanas de tratamento, mais pacientes que recebiam sorafenibe reportaram melhora do escore FKSI-10 total (55 e 44%, respectivamente) e do escore de bem-estar físico (“FACT-G PWB = Functional Assessment of Cancer Therapy – General version – Physical Well Being ”) (57 e 47%, respectivamente) em comparação com o placebo (FKSI-10, 33 e 21%; e FACT-G PWB, 37 e 21%, respectivamente).
O maior tempo de tratamento com sorafenibe verificado no estudo 1 foi de 72 semanas.
Foi um estudo Fase II, de descontinuação randomizada, que incluiu pacientes com neoplasias malignas metastáticas, incluindo o carcinoma de células renais. O objetivo primário deste estudo foi a porcentagem de pacientes randomizados (N = 65), que permaneceram sem progressão após 24 semanas. Os pacientes randomizados para sorafenibe apresentaram SLP mediana significativamente mais prolongada (163 dias) que os pacientes randomizados para placebo (41 dias; valor de p = 0,0001; HR 0,29). A taxa de SLP foi significativamente mais alta no grupo de sorafenibe (50%) que no placebo (18%) (p = 0,0077).
O maior tempo de tratamento com sorafenibe verificado no estudo 2 foi de 155 semanas.
O estudo 4 (14295) foi um estudo fase III, internacional, multicêntrico, randomizado, duplo cego, controlado com placebo, em 417 pacientes com carcinoma de tireoide diferenciado (CTD) localmente avançado ou metastático, refratário a iodo radioativo (RAI).
O desfecho primário do estudo foi a sobrevida livre de progressão (SLP). Os desfechos secundários incluíram a sobrevida global (SG), a taxa de resposta tumoral e a duração da resposta. Os pacientes que apresentaram progressão foram autorizados a receber Tosilato de Sorafenibe em esquema aberto. Não foi permitido tratamento concomitante com iodo radioativo.
O estudo de fase III (14295) recrutou pacientes com CTD histologicamente comprovado, localmente avançado ou metastático, refratário ao tratamento com iodo radioativo que tinham progredido de acordo com RECIST nos 14 meses anteriores ao recrutamento. CTD refratário a iodo radioativo foi definido como presença de uma lesão não captante de iodo em um scan com iodo radioativo, ou utilização de doses radioativas ≥ 600 mCi de iodo radioativo, ou progressão após tratamento com iodo radioativo dentro de 16 meses após o início do recrutamento ou após dois tratamentos com iodo radioativo separados por intervalos de 16 meses.
As características demográficas e dos pacientes no período basal foram bem balanceadas entre os dois grupos de tratamento. Oitenta e seis por cento (86%) dos pacientes apresentavam metástases nos pulmões, 51% nos linfonodos e 27% nos ossos. Quase todos os pacientes haviam sido submetidos à tireoidectomia (99,5%) e haviam recebido radioatividade cumulativa mediana de aproximadamente 400 mCi. A maioria dos pacientes tinha carcinoma papilífero (56,8%), seguido por carcinoma folicular (25,4%) e carcinoma pouco diferenciado (9,6%). Os pacientes incluídos no estudo apresentaram “ performance status ” ECOG 0,1,2 sendo que aproximadamente 60% dos pacientes apresentaram “ performance status ” ECOG 0.
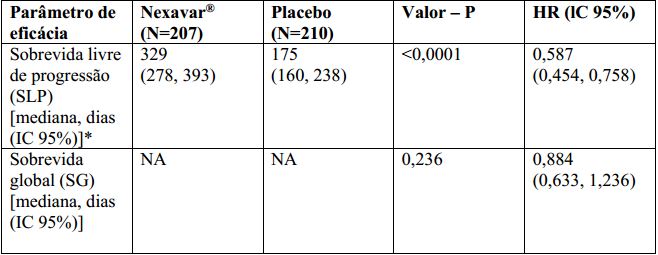
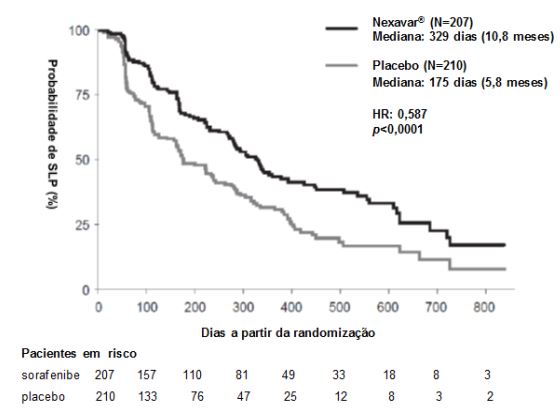
O conjunto completo para análise incluiu 207 pacientes randomizados para Tosilato de Sorafenibe 400 mg duas vezes ao dia e 210 pacientes randomizados para placebo. A SLP foi avaliada por revisão radiológica independente, cega, com base nos critérios RECIST. A mediana do tempo de SLP foi de 329 dias (10,8 meses) no grupo Tosilato de Sorafenibe comparada a 175 dias (5,8 meses) no grupo placebo. O risco relativo para a SLP (progressão da doença ou morte) foi reduzido em aproximadamente 41% nos pacientes que receberam sorafenibe em comparação com os indivíduos que receberam placebo (relação de risco [“ Hazard Ratio ” (HR)] = 0,587, Intervalo de confiança (IC) 95%: 0,454; 0,758; p unilateral <0,0001). (Tabela 2, Figura 2)
Não houve diferença estatística significamente na sobrevida global entre os grupos de tratamento (a HR foi 0,884, IC 95%: 0,633; 1,236, valor p unilateral de 0,236, Tabela 2) na análise da sobrevida global realizada 9 meses após a data de corte da análise final de SLP. A SG mediana não foi alcançada no braço sorafenibe e foi de 36,5 meses no braço placebo. Cento e cinquenta e sete (75%) pacientes randomizados para placebo e 61 (30%) randomizados para Tosilato de Sorafenibe receberam Tosilato de Sorafenibe em esquema aberto. A duração mediana da terapia no período duplo cego foi de 46 semanas (faixa 0,3 – 135) para pacientes recebendo sorafenibe e 28 semanas (faixa 1,7 – 132) para pacientes recebendo placebo. Não foi observada resposta completa (RC) de acordo com RECIST. A taxa de resposta global (RC + resposta parcial (RP)), por avaliação radiológica independente, foi mais alta no grupo de Tosilato de Sorafenibe (24 pacientes, 12,2%) do que no grupo placebo (um paciente, 0,5%), p unilateral <0,0001. A duração mediana da resposta foi de 309 dias (IC 95%: 226, 505 dias) entre os pacientes que receberam Tosilato de Sorafenibe e apresentaram RP.
Uma análise de subgrupo “ post-hoc ” sobre o tamanho máximo do tumor mostrou um efeito do tratamento para sobrevida livre de progressão favorecendo o sorafenibe com relação ao placebo para pacientes com tamanho máximo de tumor de 1,5 cm ou maior (HR 0,54; IC 95%: 0,41 – 0,71), enquanto um efeito numericamente menor foi relatado em pacientes com tamanho máximo de tumor menor que 1,5 cm (HR 0,87; IC 95%: 0,40 – 1,89).
Uma análise de subgrupo “ post-hoc ” sobre os sintomas iniciais (“ baseline ”) do carcinoma de tireoide mostrou um efeito do tratamento para sobrevida livre de progressão favorecendo o sorafenibe com relação ao placebo para pacientes sintomáticos e assintomáticos. O HR da sobrevida livre de progressão foi de 0,39 (IC 95%: 0,21 – 0,72) para pacientes com sintomas inciais (“ baseline ”) e de 0,60 (IC 95%: 0,45 – 0,81) para pacientes sem sintomas inciais (“ baseline ”).
Tabela 2: Resultados de eficácia do estudo 4 em carcinoma de tireoide diferenciado:
 NA = Não alcançado IC = Intervalo de confiança, HR = “ Hazard Ratio ” (Tosilato de Sorafenibe sobre placebo).
NA = Não alcançado IC = Intervalo de confiança, HR = “ Hazard Ratio ” (Tosilato de Sorafenibe sobre placebo).
*Revisão radiológica independente.
Figura 2: Curva de Kaplan-Meier de sobrevida livre de progressão (SLP) em carcinoma de tireoide no estudo 4 (Conjunto completo para análise):
Características Farmacológicas
O sorafenibe é um inibidor de proteínas quinases.
O sorafenibe é um inibidor de múltiplas quinases, que reduz a proliferação celular tumoral in vitro .
O sorafenibe demonstrou inibir múltiplas quinases intracelulares (c-CRAF, BRAF e BRAF mutante) e da superfície celular (KIT, FLT-3, RET, RET/PTC, VEGFR-1, VEGFR-2, VEGFR-3 e PDGFR-beta). Acredita-se que várias dessas quinases estejam envolvidas na sinalização nas células tumorais, na angiogênese e na apoptose. O sorafenibe inibiu o crescimento tumoral de carcinoma hepatocelular, carcinoma de células renais e carcinoma de tireoide diferenciado humanos e de diversos outros xenoenxertos tumorais humanos em camundongos imunocomprometidos. Foram observados redução da angiogênese tumoral em modelos humanos de carcinomas hepatocelular e celular renal no tratamento com sorafenibe, e aumento da apoptose tumoral em modelos de carcinoma hepatocelular, carcinoma de células renais e carcinoma de tireoide diferenciado. Adicionalmente foi observada redução de sinalização na célula tumoral em modelos humanos de carcinoma hepatocelular e de carcinoma de tiroide diferenciado.
Em um estudo de farmacologia clínica, medidas de QT/QTc foram registradas em 31 pacientes no estado basal (pré-tratamento) e póstratamento. Após um ciclo de tratamento de 28 dias, no tempo de concentração máxima de sorafenibe, o QTcB foi prolongado em 4 ± 19 mseg e o QTcF em 9 ± 18 mseg, comparado ao tratamento placebo no estado basal. Nenhum paciente mostrou um QTcB ou QTcF > 500 mseg durante o monitoramento por ECG no pós-tratamento.
Após administração dos comprimidos de sorafenibe, a biodisponibilidade relativa média é de 38 – 49%, quando comparada com uma solução oral. Após administração oral, o sorafenibe atinge níveis plasmáticos máximos em aproximadamente 3 horas. Quando é administrado durante uma refeição com teores moderados de gordura, a biodisponibilidade é similar à registrada em jejum. Com uma refeição rica em gordura, a biodisponibilidade do sorafenibe é reduzida em 29% em comparação com a administração em jejum.
A ligação do sorafenibe às proteínas plasmáticas humanas in vitro é de 99,5%.
O sorafenibe é metabolizado principalmente pelo fígado , sofrendo metabolismo oxidativo mediado pelo CYP3A4, assim como glicuronização mediada pelo UGT1A9.
O sorafenibe conjugado pode ser clivado no trato gastrintestinal pela atividade da glicuronidase bacteriana, o que permite a reabsorção do fármaco não conjugado. A coadministração de neomicina interfere neste processo, diminuindo a biodisponibilidade média do sorafenibe em 54%.
No estado de equilíbrio o sorafenibe representa 70-85%, aproximadamente, dos analitos circulantes no plasma. Foram identificados oito metabólitos do sorafenibe, dos quais cinco no plasma. O principal metabólito circulante no plasma, a N-óxido piridina, demonstrou potência in vitro semelhante à do sorafenibe e representa aproximadamente 9-16% dos analitos circulantes no estado de equilíbrio.
Após administração oral de uma dose de 100 mg de uma formulação de solução de sorafenibe, 96% da dose foi recuperada em 14 dias: 77% excretada nas fezes e 19% excretada na urina, como metabólitos glicuronidados. Foram encontrados 51% da dose como sorafenibe intacto nas fezes, porém não na urina.
A meia-vida de eliminação do sorafenibe é de cerca de 25 – 48 horas.
Com doses superiores a 400 mg administradas duas vezes ao dia por via oral, as C máx e AUC médias aumentam abaixo da proporcionalidade esperada.
A administração de doses múltiplas de sorafenibe por 7 dias resultou em acúmulo 2,5 a 7 vezes superior comparada à administração de dose única.
As concentrações plasmáticas do sorafenibe no estado de equilíbrio são alcançadas em 7 dias, com uma relação vale/pico das concentrações médias inferior a 2.
A farmacocinética de sorafenibe no estado de equilíbrio na posologia de 400 mg duas vezes ao dia foi avaliada em pacientes com carcinoma de tireoide, CCR e CHC. A exposição média mais alta foi observada em pacientes com carcinoma de tireoide, embora a variabilidade na exposição tenha sido alta para todos os tipos de tumores. A relevância clínica do aumento da AUC em pacientes com carcinoma de tireoide é desconhecida.
Tabela 3: AUC(0-12)ss plasmática de sorafenibe no estado de equilíbrio de pacientes com carcinoma de tireoide diferenciado, CCR e CHC (média geométrica (%CV) [intervalo]):


Os estudos realizados em microssomos hepáticos humanos demonstraram que sorafenibe é um inibidor competitivo de CYP2C19, CYP2D6 e CYP3A4. A administração clínica concomitante de midazolam, dextrometorfano e omeprazol , que são substratos dos citocromos CYP3A4, CYP2D6 e CYP2C19, respectivamente, após 4 semanas de administração do sorafenibe, não alterou a exposição à esses agentes, indicando que o sorafenibe não é indutor nem inibidor destas isoenzimas do citocromo P450.
Dados in vitro mostram que o sorafenibe inibe a glicuronização por meio das vias UGT1A1 (Ki=1µM) e UGT1A9 (Ki=2µM). A administração clínica concomitante de sorafenibe com irinotecano, cujo metabólito ativo SN-38 segue sendo metabolizado pela via UGT1A1, resultou em um aumento de 67 – 120% na AUC do SN-38. A exposição sistêmica a substratos de UGT1A1 e UGT1A9 pode aumentar quando coadministrados com o sorafenibe.
O sorafenibe inibe CYP2B6 e CYP2C8 in vitro , com valores de Ki de 6 µM e 1 - 2 µM, respectivamente. A administração clínica concomitante de sorafenibe com paclitaxel resultou em um aumento, ao invés de diminuição, na exposição ao paclitaxel 6-OH, metabólito ativo do paclitaxel que é formado pelo CYP2C8. Esses dados sugerem que sorafenibe pode não ser um inibidor in vivo do CYP2C8.
A administração concomitante de sorafenibe e ciclofosfamida resultou em uma pequena diminuição na exposição à ciclofosfamida, mas não diminuiu a exposição sistêmica à 4-OH ciclofosfamida, metabólito ativo da ciclofosfamida formado principalmente pelo CYP2B6. Esses dados sugerem que o sorafenibe pode não ser um inibidor in vivo do CYP2B6.
Os estudos realizados com microssomos hepáticos humanos demonstraram que sorafenibe é um inibidor competitivo de CYP2C9, com um valor de Ki = 7 – 8 µM. O possível efeito de sorafenibe sobre um substrato CYP2C9 foi avaliado em pacientes que receberam sorafenibe ou placebo em combinação com varfarina . Nos pacientes que receberam sorafenibe, as alterações médias de PT-RNI a partir dos valores basais não foram superiores àquelas dos pacientes que receberam placebo, sugerindo que sorafenibe pode não ser um inibidor de CYP2C9 in vivo .
O cetoconazol (400 mg), um potente inibidor do CYP3A4, administrado uma vez ao dia durante 7 dias a voluntários sadios do sexo masculino, não alterou a AUC média de uma dose única de 50 mg de sorafenibe. Portanto, interações farmacocinéticas clínicas do sorafenibe com inibidores do CYP3A4 são improváveis.
As atividades dos CYP1A2 e CYP3A4 não foram alteradas após tratamento de cultura de hepatócitos humanos com sorafenibe, indicando que é improvável que o sorafenibe seja um indutor do CYP1A2 e CYP3A4.
A administração clínica concomitante contínua de sorafenibe e rifampicina resultou em uma redução média de 37% da AUC do sorafenibe. Outros indutores da atividade do CYP3A4 (p. ex., Hypericum perforatum , também conhecida como Erva de São João, fenitoína , carbamazepina , fenobarbital e dexametasona ) também podem aumentar o metabolismo do sorafenibe e, portanto, diminuir a sua concentração.
Em estudos clínicos, administrou-se sorafenibe em combinação com uma série de outros agentes antineoplásicos, em seus regimes de dose comumente utilizados, incluindo gencitabina , cisplatina , oxaliplatina , paclitaxel , carboplatina , capecitabina , doxorrubicina , docetaxel , irinotecano e ciclofosfamida . O sorafenibe não teve efeito clinicamente relevante na farmacocinética da gencitabina , cisplatina, carboplatina, oxaliplatina ou ciclofosfamida.
A administração de paclitaxel (225 mg/m 2 ) e carboplatina (AUC = 6) com sorafenibe (≤ 400 mg duas vezes ao dia), administrados com uma pausa de 3 dias na administração de sorafenibe em torno da administração de paclitaxel / carboplatina, não resultou em efeito significante na farmacocinética do paclitaxel.
A coadministração de paclitaxel (225 mg/m 2 , uma vez a cada 3 semanas) e carboplatina (AUC = 6) com sorafenibe (400 mg duas vezes ao dia, sem pausa na administração de sorafenibe) resultou em um aumento de 47% da exposição ao sorafenibe, 29% da exposição ao paclitaxel e 50% da exposição ao 6-OH paclitaxel. A farmacocinética da carboplatina não foi afetada.
Esses dados indicam que não é necessário ajuste de dose quando paclitaxel e carboplatina são coadministrados com sorafenibe com pausa de 3 dias na administração de sorafenibe. A relevância clínica do aumento da exposição ao sorafenibe e ao paclitaxel, após a coadministração sem pausa na administração de sorafenibe é desconhecida.
A coadministração de capecitabina (750 – 1.050 mg/m 2 , duas vezes ao dia, dias 1 – 14 a cada 21 dias) e sorafenibe (200 ou 400 mg duas vezes ao dia, administração contínua ininterrupta) não resultou em alteração significativa da exposição ao sorafenibe, mas em um aumento de 15 – 50% da exposição à capecitabina e em um aumento de 0 – 52% da exposição à 5-FU. A relevância clínica deste aumento leve a moderado na exposição à capecitabina e ao 5-FU quando coadministrados com sorafenibe é desconhecida.
O tratamento concomitante com sorafenibe resultou em aumento de 21% na AUC da doxorrubicina.
Quando se administrou com irinotecano, cujo metabólito ativo SN-38 segue sendo metabolizado pela via UGT1A1, produziu-se aumento de 67 – 120% da AUC do SN-38 e aumento de 26 – 42% da AUC do irinotecano. Não se conhece a relevância clínica desses resultados.
A coadministração de sorafenibe (200 mg duas vezes/dia ou 400 mg duas vezes/dia, administrados do 2° ao 19° dias de cada ciclo de 21 dias) e docetaxel (75 ou 100 mg/m², administrado uma vez a cada 21 dias) com uma pausa de 3 dias em torno da administração de docetaxel resultou em um aumento de 36–80% na AUC de docetaxel e de 16–32% na C máx de docetaxel. Recomenda-se cautela ao administrar sorafenibe com docetaxel.
A coadministração de neomicina, um agente antimicrobiano não sistêmico, utilizado na erradicação da flora gastrintestinal, interfere com a reciclagem entêrohepática do sorafenibe resultando na diminuição da exposição a esse fármaco. Em voluntários sadios, tratados com neomicina por 5 dias, a biodisponibilidade média do sorafenibe diminuiu em 54%. A relevância clínica desses achados é desconhecida. Efeitos de outros antibióticos não foram estudados, mas provavelmente dependerão da capacidade do antibiótico em diminuir a atividade da glicuronidase.
A coadministração de omeprazol não tem impacto na farmacocinética do sorafenibe. Não é necessário ajustar a dose do sorafenibe.
Não se dispõem de dados farmacocinéticos em pacientes pediátricos.
A análise dos dados demográficos sugere que não é necessário efetuar ajustes de dose por idade.
O sorafenibe é depurado principalmente pelo fígado.
Em pacientes com carcinoma hepatocelular com insuficiência hepática leve (Child-Pugh A) ou moderada (Child-Pugh B), os valores de exposição ficaram dentro do intervalo observado em pacientes sem insuficiência hepática. A farmacocinética do sorafenibe em pacientes sem carcinoma hepatocelular, mas que apresentavam insuficiência hepática leve (Child-Pugh A) ou moderada (Child-Pugh B), foi similar à farmacocinética de voluntários sadios. A farmacocinética de sorafenibe não foi estudada em pacientes com insuficiência hepática grave (Child-Pugh C).
Em um estudo clínico farmacológico, a farmacocinética do sorafenibe foi avaliada após administração de uma dose única de 400 mg a indivíduos com função renal normal e a indivíduos com insuficiência renal leve (ClCr 50 – 80 mL/min), moderada (ClCr 30 a < 50 mL/min) ou insuficiência renal grave (ClCr < 30 mL/min) sem necessidade de diálise.
Não foi observada nenhuma relação entre a exposição ao sorafenibe e a função renal. Não é necessário efetuar ajustes de dose na insuficiência renal leve, moderada ou grave que não requer diálise.
A análise dos dados demográficos sugere que não é necessário efetuar ajustes de dose por gênero.
O perfil de segurança pré-clínico de sorafenibe foi avaliado em camundongos, ratos, cães e coelhos.
Estudos de toxicidade com doses repetidas revelaram alterações leves a moderadas (degenerações e regenerações) em vários órgãos.
Após administração repetida a cães jovens e em crescimento, foram observados efeitos nos ossos e dentes. As alterações consistiram de espessamento irregular das epífises femurais, com uma dose diária de sorafenibe de 600 mg/m 2 de superfície corporal (equivalente a 1,2 vezes a dose terapêutica recomendada de 500 mg/m 2 de superfície corporal); hipocelularidade da medula óssea próxima das epífises alteradas, com a dose de 200 mg/m 2 /dia; e alterações da composição da dentina, com 600 mg/m 2 /dia.
Não foram induzidos efeitos semelhantes em cães adultos.
Efeitos genotóxicos positivos foram obtidos para o sorafenibe em um ensaio in vitro de clastogenicidade (aberrações cromossômicas) em células de mamíferos (ovário de hamster chinês) na presença de ativação metabólica. Uma substância intermediária no processo de fabricação, que também está presente no fármaco final (< 0,15%), foi positiva para mutagênese em um ensaio bacteriano in vitro (teste de Ames). O sorafenibe não foi genotóxico no teste de Ames (o material continha 0,34% da substância intermediária) e em um ensaio in vivo com micronúcleos de camundongo.
O sorafenibe mostrou-se embriotóxico e teratogênico quando administrado a ratos e coelhos. Os efeitos observados incluíram reduções nos pesos corporais materno e fetal, aumento do número de reabsorções fetais e aumento do número de malformações externas e viscerais. Os desfechos adversos para o feto foram observados com uma dose oral de 6 mg/m 2 /dia em ratos e 36 mg/m 2 /dia em coelhos.
Não foram realizados estudos de carcinogenicidade com sorafenibe.
Não foram realizados estudos específicos com sorafenibe em animais para avaliar o efeito na fertilidade. Entretanto, pode-se esperar um efeito adverso sobre a fertilidade masculina e feminina, pois os estudos com doses repetidas em animais mostraram alterações nos órgãos reprodutores de machos e fêmeas.
Interação alimentar
Veja “Posologia e Modo de Usar”.